新闻 凝血
免疫比浊法检测凝血因子XIII抗原参考区间的建立
一月 6, 2023 - 中国

作者:梁永钢
单位:郑州大学附属郑州中心医院
审稿人:吴俊
单位:北京积水潭医院
前言
凝血因子XIII(FXIII)是凝血过程中最后一步的关键酶,因其具有促使纤维蛋白之间形成共价键交联、稳定血浆纤维蛋白凝块的作用,因而也被称作纤维蛋白稳定因子。此外,FXIII还可促进抗纤溶酶与纤维蛋白的结合,抑制纤溶系统作用的发挥[1],因此FXIII缺乏可导致严重的反复自发性出血,且出血部位广泛,主要表现为皮肤黏膜淤斑、软组织及肌肉血肿、内脏出血、术后延迟性出血甚至颅内出血等[2-3]。
由于FXIII缺乏时通常不会表现为常规凝血项目(例如PT,APTT)异常[4],因此临床上非常容易漏诊。对于FXIII缺乏症的诊断,《罕见遗传性出血性疾病诊断与治疗中国专家共识(2021版)》指出,常用的尿素溶解试验的敏感性较差,诊断率低。FXIII活性检测敏感性高,但是目前仅极少数实验室能开展。而通过免疫学方法进行FXIII抗原检测,稳定性好,而且简便准确。
参考区间是临床医生解释检验结果、做出临床决策的重要依据。因此临床应用时应建立自己实验室FXIII的参考范围。
经过
参照WS/T 402-2012《临床实验室检验项目参考区间的制定》[5],通过问卷调查、体格检查、实验室检查等方式,筛选出在本院体检的健康汉族成年人共246例(年龄范围18-60岁),采清晨空腹静脉血,枸橼酸钠抗凝,充分混匀。排除不合格标本(采血量不足、溶血、脂血或出现血凝块)。1500g/15min离心后获得乏血小板血浆上机检测。
本次参考区间建立使用ACL TOP 700全自动凝血分析仪,FXIII抗原检测试剂盒(免疫比浊法)(分析仪和试剂均来自沃芬公司)。利用SPSS 26软件的箱式图与茎叶图法剔除实验结果的离群值,保证研究对象的均质性。以性别分组,男性组(124例)和女性组(122例)的FXIII抗原分布接近正态分布(两组P>0.05),且不存在离群值,同时经Levene's方差齐性检验两组方差齐(p=0.281)。结果显示,男性FXIII抗原水平为85.5±16.2%,与女性结果82.9±14.6%接近。独立样本t检验结果提示,t=0.848,P=0.397(大于0.05),说明男性的凝血因子XIII抗原水平与女性没有差异(图1)。
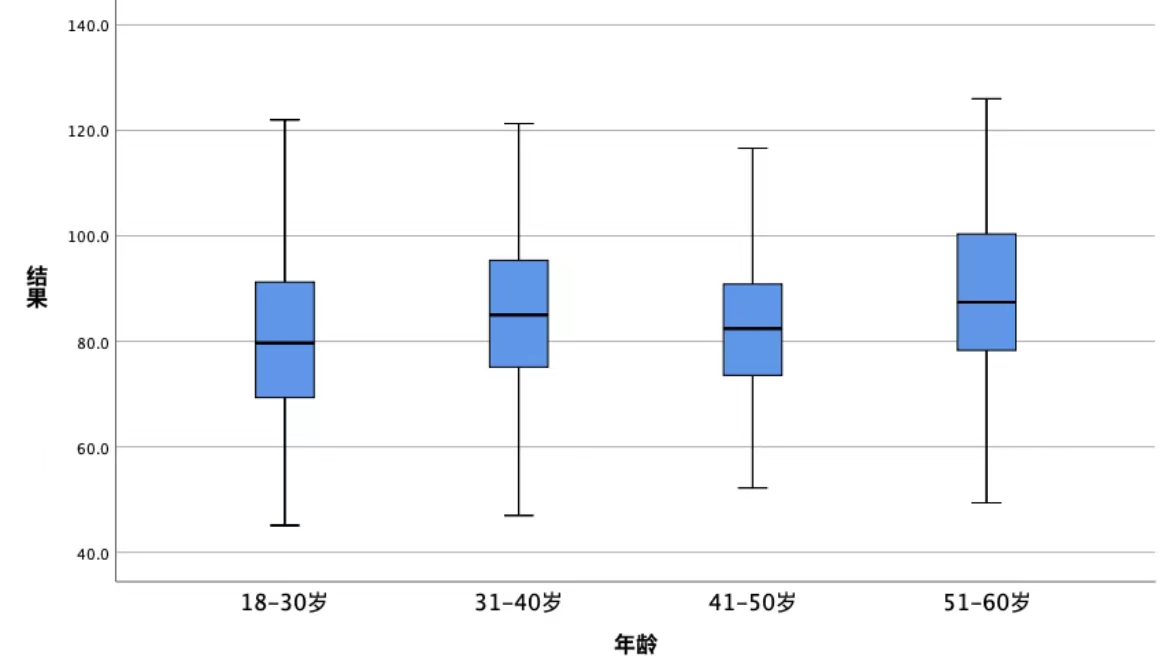
以年龄不同研究对象被分为4组,18-30岁组66例,31-40岁组67例,41-50岁组59例,51-60岁组54例。采用单因素方差分析法,判断不同年龄组的FXIII抗原水平是否存在差异。经箱线图判断,数据无异常值;经Shapiro-Wilk检验,各组数据服从正态分布(P>0.05);经Levene's方差齐性检验,各组数据方差齐(P =0.937)。数据以均数±标准差的形式表示,FXIII抗原水平分别为:18-30岁组(81.0±15.7%),31-40岁组(84.9±15%),41-50岁组(83.6±14.8%),51-60岁组(88±16%)。不同年龄组间FXIII水平差异没有统计学意义,F=1.608,P=0.189(图2)。
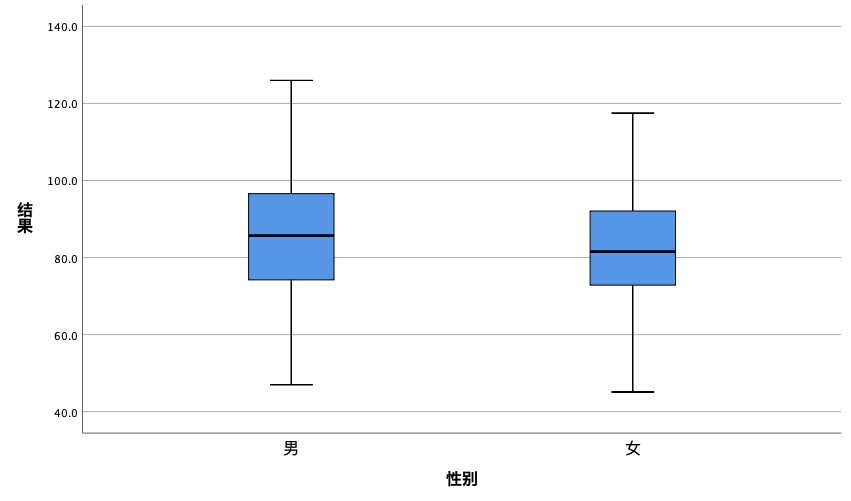
图1 不同性别研究对象的FXIII抗原水平的比较
纳入的246例研究对象,男女比例为1:0.98,经 Shapiro-Wilk 检验,FXIII抗原数据呈正态分布(P>0.05)。FXIII抗原水平为84.2±15.5%。按照WS/T 402-2012,运用正态分布法,计算FXIII抗原的95%参考区间为53.8%-114.6%,比厂家提供的参考范围低。经过20个参考个体的小样本验证,该参考区间符合本地人群特征。
总结
确定参考区间上、下限的方法包括参数法和非参数法,非参数法应用于偏态分布数据,要求每组样本量不少于120例,参数法要求数据呈正态分布,常以x±1.96s作为参考区间的上、下限。本研究数据分布满足正态分布要求,因此选用参数法建立参考区间,以x±1.96作为参考区间上、下限。与非参数法相比,参数法建立的参考区间范围更小[6]。本研究初步建立了适合免疫比浊法检测凝血因子XIII抗原的参考区间,人群选择、 界定、研究个体数量、 统计方法与检测结果可溯源性均符合美国临床实验室标准化协会提出的关于建立通用参考区间要求。
本研究的不足之处在于研究对象健康个体的数量有限,缺乏多中心的研究,以后还需纳入更多健康个体或基于累计数据的大数据量建立参考区间以利于临床诊断。综上所述,本研究采用直接法建立FXIII抗原参考区间是可行的,具有简单易获得和参考区间范围窄的优势。
知识拓展
FXIII缺乏分为遗传性和获得性。遗传性FXIII缺乏症是一种罕见的常染色体隐性遗传病,发病率约1/100万~500万。遗传性FXIII缺乏的患者自出生即可有严重出血倾向,而且任何年龄都可能在没有其他出血征兆的情况下突然出现致命性出血。获得性FXIII缺乏多见于术后第3~6天,各种严重肝病,铅、汞、磷中毒,白血病,淋巴瘤,多发性骨髓瘤,红斑狼疮,类风湿关节炎,尿毒症及DIC等。获得性FXIII缺陷多为合成或消耗减少所致。
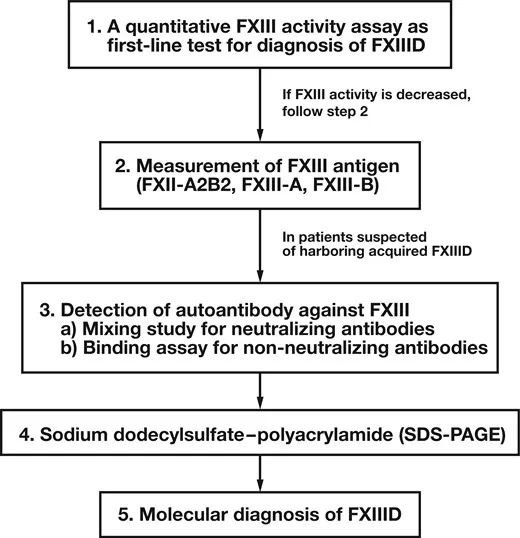
图3 ISTH[7]推荐的FXIII缺陷的诊断的流程
尿素溶解实验(也有用1%一氯醋酸、2%三氯乙酸等)等定性实验敏感性差,ISTH已不再推荐。然而由于暂时没有替代的活性检测方法,目前仍为部分实验室使用。FXIII活性的定量检测,某些产品由于缺少空白对照,会导致低值样本检测结果虚高,造成临床误判FXIII缺陷的程度,并且国外已有相关研究报道 [8-10]。FXIII抗原的定量检测,其检测结果和FXIII活性检测有着较好的一致性,其结果通常显示出对FXIII缺陷预期水平的良好准确性。目前沃芬的FXIII抗原检测试剂盒是唯一取得FDA及国家药监局的认证的产品。
综上,当临床怀疑FXIII缺陷时,实验室应考虑将尿素溶解实验和FXIII抗原定量检测相结合的策略,以实现对FXIII缺陷的诊断及治疗监测的基本需求。
本文作者
梁永钢
长期从事出凝血疾病检验与临床工作,河南省微循环协会检验医学分会委员,河南省生物化学与分子生物学会委员,河南省艾滋病防治协会检验分会委员,发表论文数篇,参编医学专著2部,曾获河南省首届临床检验技能大赛三等奖,2021年在北京协和医院检验科进修六个月。
本文审稿人
吴俊
国家卫健委能力建设与继续教育中心血栓与止血组长,中国医院协会临床检验专业委员会委员,中华医学会检验分会第十届委员会血液体液学组委员,中国医学装备协会现场快速检测(POCT)装备技术分会副会长,中国医疗器械行业协会现场快速检测(POCT)分会副主任委员,中国中西医结合学会检验分会第二届委员会委员(血液学组副主任委员),北京临检中心血栓与止血专家委员会常务副主委, 北京检验学会常委/血凝学组长,北京医院协会临床检验管理委员会常委/秘书。中华医学检验杂志、临床检验杂志、北京大学学报( 医学版)、中国医学科学院学报,JTH 等杂志编委及审稿。参编、副主编著作 6 部,以第一作者发表论文 50 余篇。获得多项研究基金。
参考文献
[1] Sad, ElAlaoui, Vincent, et al. Development and evaluation of a modified colorimetric solid-phase microassay for measuring the activity of cellular and plasma (Factor XIII) transglutaminases[J]. Biotechnology and Applied Biochemistry, 2006, 43(3):171-179.
[2] Muszbek, Bereczky, Bagoly, et al. Factor XIII: A Coagulation Factor With Multiple Plasmatic and Cellular Functions[J]. Physiological Reviews, 2011, 91(3):931–972.
[3] 项威, 赵刚, 杜波,等. 凝血因子XⅢ缺乏导致术后颅内迟发血肿的诊断和治疗[J]. 中华神经医学杂志, 2008, 7(8):3.
[4] KATONA E, PENZES K, MOLNAR E, et al. Measurement of factor XIII activity in plasma [J]. Clin Chem Lab Med, 2012, 50(7): 1191-202.
[5] 中华人民共和国国家卫生健康委员会. WS/T 402—2012 临床实验室检验项目参考区间的制定 [M]. 2012.
[6] 程霞, 王卓, 杨丹, et al. 临床实验室APTT ACTIN FSL试剂建立活化部分凝血活酶时间参考范围 [J]. 血栓与止血学, 2020, 26(4): 579-81,84.
[7] Kohler HP, Ichinose A, Seitz R, Ariens RAS, Muszbek L, on behalf of the Factor XIII and Fibrinogen SSC Subcommittee of the ISTH. Diagnosis and classification of factor XIII deficiencies. J Thromb Haemost 2011; 9: 1404–6.
[8] Lim W, Moffat K, Hayward CPM. Prophylactic and perioperative replacement therapy for acquired factor XIII deficiency. J ThrombHaemost 2004;2(6):1017–1019
[9] Jennings I, Kitchen S,Woods TA, Preston FE; UK NEQAS. Problems relating to the laboratory diagnosis of factor XIII deficiency: a UK NEQAS study. J Thromb Haemost 2003;1(12):2603–2608
[10] Hsu P, Zantek N D, Meijer P, et al. Factor XIII Assays and Associated Problems for Laboratory Diagnosis of Factor XIII Deficiency: An Analysis of International Proficiency Testing Results[J]. Seminars in Thrombosis & Hemostasis, 2014, 40(02):232-238.
更多内容,请扫描以下二维码。

留下您的联系方式。
werfenchina@werfen.com
电话: +86-10-5975-6055